در یک واکنش شیمیایی، به حالتی تعادل شیمیایی میگویند که در آن، واکنشدهندهها و فرآوردهها در غلظتهایی حضور دارند که با گذشت زمان، تغییر نمیکنند. در نتیجه، شاهد تغییرات در خواص سیستم نخواهیم بود.
به طور معمول، این حالت زمانی بوجود میآید که واکنش رفت و واکنش برگشت، هر دو با یک سرعت انجام شوند. در حقیقت، سرعت واکنشهای رفت و برگشت صفر نیست بلکه یکسان است. بنابراین، هیچ تغییری در غلظت واکنشدهندهها و فرآوردهها نخواهیم داشت. به این حالت، «تعادل دینامیک» (Dynamic Equilibriuim) یا تعادل پویا میگویند.
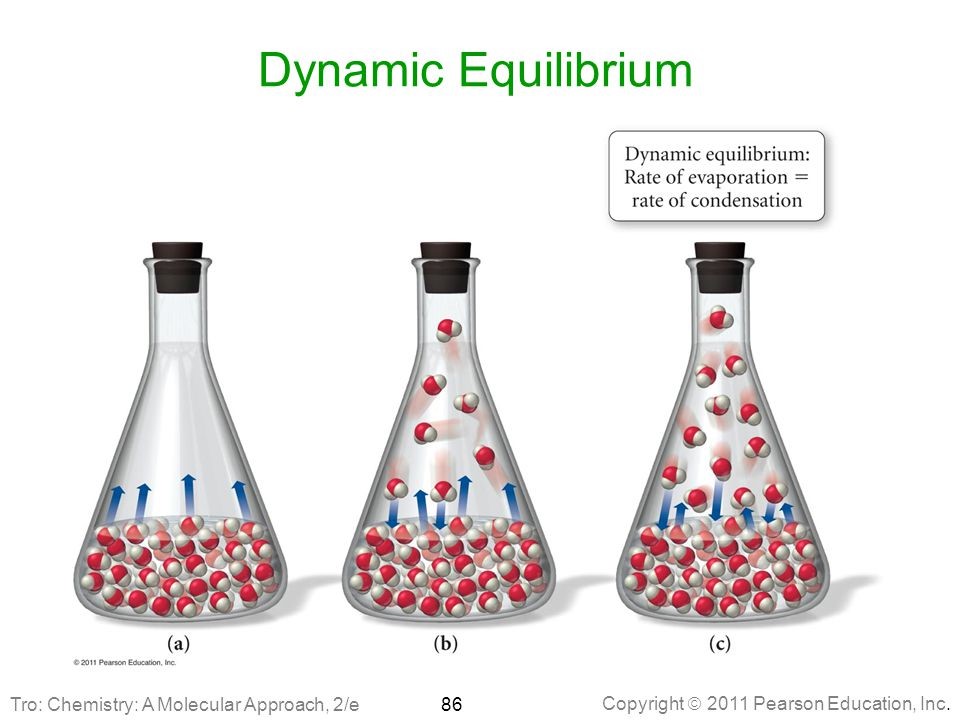
در این حالت غلظت واکنش دهنده ها و محصولات ثابت و سرعت واکنش های رو به جلو و رو به عقب با هم برابر است. جالب است بدانید واکنش ها پس از رسیدن به تعادل متوقف نمی شوند و بیشتر قوانین تعادل برای فرایند برگشت پذیر اعمال می شود، از این رو تعادل شیمیایی در یک واکنش برگشت پذیر اتفاق می افتد. تعادل را یک فرایند دینامیکی در نظر می گیرند، اگرچه واکنش ها قابل مشاهده نیستند اما به صورت رفت و برگشتی انجام می شوند.
مبانی تعادل شیمیایی:
همانطور که در بالا به آن اشاره شد، تعادل شیمیایی حالتی است که در آن، سرعت واکنش رفت با سرعت واکنش برگشت برابر است. واکنش اساسی زیر را در نظر بگیرید:
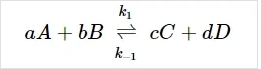
سرعت واکنش رفت را میتوان به کمک رابطه زیر نشان داد:
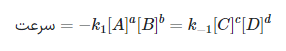
که در رابطه بالا، k1k1 و k−1k−1، «ثابتهای واکنش» (Reaction Constants) به ترتیب برای واکنشهای رفت و برگشت هستند. توجه داشته باشید که مقدار k، در واکنشها و دماهای مختلف، متفاوت خواهد بود.
زمانی که سرعت صفر باشد، غلظتهای خالص A، B، C و D با یکدیگر در تعادل قرار دارند. در نتیجه، اگر تغییری در سیستم، بواسطه تغییر در غلظت، دما یا فشار اتفاق بیافتد، تعادل در جهت توازن این تغییرات پیش خواهد رفت و تعادل جدیدی بر مبنای اصل لوشاتلیه بوجود خواهد آمد. به این نکته توجه داشته باشید که حضور کاتالیزور، هیچ جابجایی را در تعادل صورت نمیدهد و تنها سبب میشود تا واکنش، زودتر به تعادل برسد چراکه کاتالیزورها تنها انرژی فعالسازی را کاهش میدهند.
ویژگی های اصلی تعادل شیمیایی :
برای ایجاد این حالت، سیستم باید بسته (نه ماده ای از آن خارج و نه به آن وارد شود) و واکنش مربوطه از نوع برگشت پذیر باشد. خواص قابل رویت سیستم مانند رنگ، فشار، غلظت و غیره پس از رسیدن به حالت تعادل ثابت و بدون تغییر باقی می ماند. پس از تعادل مقدار واکنش دهنده ها و محصولات ثابت خواهد ماند و تمام واکنش دهنده ها و محصولات در حالت تعادل هستند. همچنین سرعت واکنش های رفت و برگشت با هم برابر است و موقعیت تعادل تحت تأثیر کاتالیزورها قرار نمی گیرد.
ویژگی های یک سیستم در حال تعادل
سرعت واکنش رفت با برگشت برابر است.
سیستم بسته بوده و مبادله جرم با محیط ندارد.
غلظت، رنگ و دیگر خواص ماکروسکوپی بدون تغییر هستند.
در بررسی میکروسکوپی سیستم پویا است و واکنش رفت و برگشت در سطح مولکولی دائما انجام می شوند.
انواع تعادل:
در حالت کلی، تعادل را به دو بخش می توان تقسیم کرد.
تعادل فاز
یک ماده بین دو حالت فیزیکی در تعادل باشد. برای مثال برای ایجاد تعادل در یک فلاسک آب، باید سرعت تبخیر آب با سرعت میعان آن برابر باشد.
تعادل محلول
یعنی یک ماده ی جامد در یک محلول اشباع در تعادل باشد، برای ایجاد این حالت باید سرعت انحلال با سرعت تبلور مجدد برابر باشد.
در ادامه انواع تعادل شیمیایی را مورد بررسی قرار خواهیم داد.
انواع تعادل شیمیایی:
این حالت را می توان به دو گروه تقسیم کرد:
1- تعادل همگن:
در اینجا محصولات و واکنش دهنده ها در یک فاز قرار دارند. تعادل همگن هم می تواند به دو نوع تقسیم شود:
واکنش هایی که تعداد مولکول های محصولات برابر با مولکول های واکنش دهنده است، مانند:
H2(g) + I2(g) ⇔2HI(g)
N2(g) + O2(g) ⇔2NO(g)
واکنش هایی که تعداد مولکول های محصولات با تعداد مولکول های واکنش دهنده ها برابر نیست، مانند:
2SO2(g) + O2(g) ⇔ 2SO3(g)
COCl2(g) ⇔ CO(g) + Cl2(g)
2- تعادل ناهمگن:
در این تعادل محصولات و واکنش دهنده ها در فازهای متفاوتی قرار دارند. مانند:
CO2(g) + C(s) ⇔ 2CO(g)
CaCO3(s) ⇔ CaO(s) + CO2(g)
تعادل شیمیایی برحسب فاز واکنش دهنده ها و محصولات تقسیم بندی می شود.
قانون تعادل شیمیایی:
واکنش فرضی برگشت پذیر اولیه زیر را در یک ظرف در بسته در نظر بگیرید.
A و B با هم واکنش داده و محصولات C و D را تولید می کنند، در نظر داشته باشید که این واکنش می تواند در جهت معکوس نیز اتفاق بیافتد. این واکنش تا جایی پیش می رود که غلظت و سرعت واکنش در طرفین با هم برابر شود و سیستم به تعادل برسد. پس از این مرحله دیگر تغییری در غلظت هیچکدام از محصولات ایجاد نمی شود.
ثابت تعادل:
نسبت غلظت تعادلی محصولات تقسیم بر غلظت تعادلی واکنش دهنده ها، که هرکدام به اندازه ی قدرت استوکیومتری آنها افزایش می یابد را ثابت تعادل می گویند.
در واقع هر غلظت به اندازه ی توان ضریب خود در معادله ی شیمیایی افزایش می یابد. این کمیت مستقل از غلظت های اولیه محصولات و واکنش دهنده ها و وابسته به دما است.
عوامل تاثیر گذار بر تعادل:
عواملی مانند دما، فشار، غلظت وجود دارند که بر تعادل تاثیر می گذارند.
غلظت:
هرگاه غلظت واکنش دهنده ها یا محصولات تغییر کند، ترکیب مخلوط تغییر کرده و تعادل شیمیایی ایجاد می شود.
تغییر فشار:
تغییر فشار در سیستم های گازی با سیستم های مایعات و جامدات متفاوت است. در سیستم های گازی تغییر فشار به معنای تغییر حجم است، یعنی تعداد کل واکنش دهنده ها و محصولات تغییر کرده است. اما در تعادل ناهمگن در سیستم های مایعات و جامدات تغییر فشار را بر طبق اصل لوشاتلیه در نظر نمی گیریم.
تغییر دما:
تغییر دما باعث تغییر سرعت های واکنش در نتیجه تغییر ثابت تعادل می شود. اگر ثابت تعادل بزرگتر از یک باشد، غلظت محصولات بیشتر از غلظت واکنش دهنده ها است. ثابت تعادل کمتر از یک، غلظت واکنش دهنده ها بیشتر از محصولات و ثابت تعادل برابر با یک یعنی غلظت محصولات و واکنش دهنده ها با هم برابر است.
تاثیر دما بر تعادل شیمیایی به علامت آنتالپی وابسته است. برای مثال با افزایش دما، ثابت تعادل در یک واکنش گرمازا کاهش و در یک واکنش گرماگیر افزایش می یابد. همچنین سرعت واکنش نیز به دما وابسته است.
کاتالیزور:
کاتالیزورها فقط سرعت واکنش ها را افزایش می دهند، از این رو بر تعادل شیمیایی تاثیری ندارند و تنها باعث می شوند واکنش ها زودتر به تعادل برسد.
گاز بی اثر:
فرض کنید یک گاز بی اثر مانند آرگون به حجم ثابتی اضافه شود، این گاز در واکنش شرکت نخواهد کرد از این رو تاثیری بر تعادل نخواهد داشت.
چرا به تعادل شیمیایی، تعادل دینامیکی یا پویا می گویند؟
در مرحله تعادل سرعت واکنش های رفت و برگشت و تعداد مولکول هایی تبدیلی به محصول با تعداد مولکول های تبدیلی به واکنش دهنده با هم برابرند. همین واکنش تعادل را می توان با واکنش دهنده های مشابه، در شرایط مشابه با مبادله مداوم مولکول ها انجام داد. در واقع حالت دینامیکی یا پویا یعنی هیچ تغییر خالصی در غلظت واکنش دهنده ها و محصولات رخ ندهد، این همان اتفاقی است که در تعادل شیمیایی رخ می دهد.
تعادل شیمیایی در صنعت:
در بسیاری از فرایندهای صنعتی از تعادل شیمیایی بهره می برند. برای مثال تهیه آمونیاک با فرایند هابر را در نظر بگیرید. نیتروژن با هیدروژن ترکیب می شود و آمونیاک را می سازد. بازده آمونیاک در دمای پایین، فشار بالا و حضور آهن به عنوان کاتالیزور افزایش می یابد.
کاربرد تعادل شیمیایی
تهیه آمونیاک: در فرایند هابر بر اثر اختلاط هیدروژن و نیتروژن، آمونیاک تشکیل میشود و واکنش تعادلی موجود در دمای پایین، فشار بالا و استفاده از کاتالیزور آهن بازده بهتری داشته و آمونیاک بیشتری تولید می کند.
N2(g)+3H2(g)⇌2NH3(g) ΔH=−92.4kJ/mol
در تولید سولفوریک اسید: یکی از عمده ترین روش های تولید این ماده فرایند مجاورت است که اساس آن اکسیداسیون دی اکسید گوگرد به تری اکسید گوگرد است و شامل تعادل شیمیایی است.
یکی دیگر از کاربردهای مهم تعادل شیمیایی در هموگلوبین خون وجود دارد. هموگلوبین می تواند با اکسیژن ترکیب شده و در نتیجه به بافت مختلف بدن خون برساند. واکنش ترکیب شدن هموگلوبین و اکسیژن یک واکنش برگشت پذیر و تعادلی است و تا زمانیکه در تعادل آن خللی ایجاد نشود، اکسیژن رسانی خون به درستی انجام می گیرد.
فناوری تولید آمونیاک به روش هابر
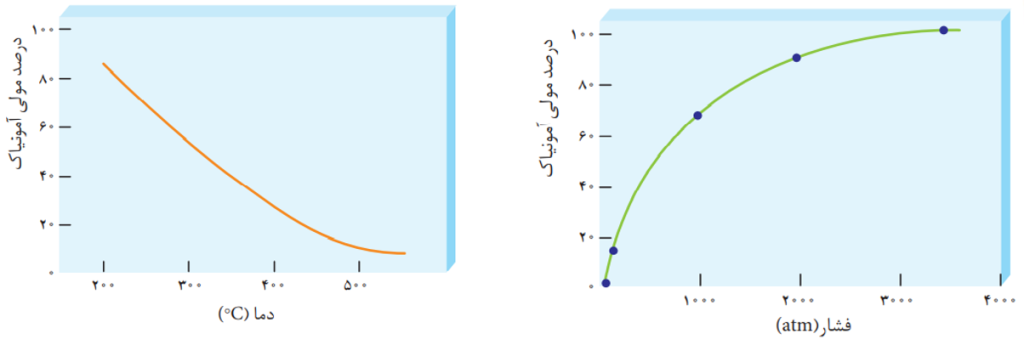
در فرآیند تولید آمونیاک، فریتس هابر با کمک عامل موثر بر تعادل توانست شرایط بهینه را برای تعادل پیدا کند. هابر می دانست که با افزایش دما سرعت واکنش افزایش می یابد. به همین دلیل دما را بالا برد ولی متوجه شد که بر طبق اصل لوشاتلیه و جابه جایی تعادل در جهت برگشت پیشرفت واکنش و درصد مولی آمونیاک کاهش می یابد.
بنابراین به جای افزایش بیش از حد دما از کاتالیزگر استفاده کرد و در دماهای به نسبت کمتری واکنش را با سرعت مناسب انجام داد. در ضمن وی از افزایش فشار بر سامانه نیز استفاده کرد و به این ترتیب توانست 28 درصد مولی آمونیاک را در مخلوط نهایی به دست آورد.
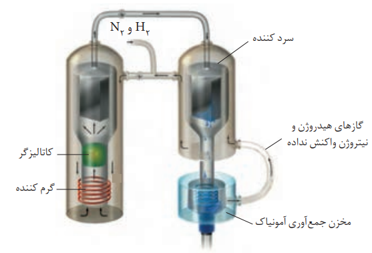
با توجه به نقطه ی جوش گازهای آمونیاک، نیتروژن و هیدروژن، هابر از دمای (C40-) برای مایع کردن آمونیاک و خارج کردن آن در دستگاه سرد کننده استفاده کرد.
قیمت خرید مواد شیمیایی صنعتی و خوراکی
مواد شیمیایی مختلف یکی از مواد اولیه ضروری برای تولید محصولات مختلف صنعتی و خوراکی به شمار می رود. کیفیت مواد شیمیایی مصرفی در بخش تولید ازجمله فاکتورهای مهمی است که به هنگام خرید باید درنظر گرفته شود. شرکت کهان تاک از تامین کنندگان معتبر انواع مواد شیمیایی در طول سال های فعالیت خود اصل بودن مواد عرضه شده را در دستور کار خود قرار داده است. جهت اطلاع از قیمت انواع مواد شیمیایی مورد نیاز خود و نحوه ثبت خرید به صورت عمده می توانید با کارشناسان فروش کهان تاک تماس حاصل نمایید.
جمع بندی:
برابری بین واکنش دهنده ها و محصولات در یک واکنش شیمیایی را تعادل شیمیایی می نامند. به دلیل عدم تغییر غلظت در واکنش دهنده ها و فراورده ها این حالت را تعادل دینامیکی یا پویا نیز می نامند. تعادل را می توان به دو گروه همگن و ناهمگن تقسیم بندی کرد. همچنین عواملی چون فشار، دما و غلظت از عوامل موثر بر این حالت به حساب می آیند.